«Оценка клинической эффективности гидролизата белка дрожжей сублимационной сушки у пациентов с ожирением и сердечной недостаточностью на фоне гипокалорийной диеты»
Гиоева З.М.1, Богданов А.Р.1,2, Зайнудинов З.М.1, Хотимченко С.А.1
1- ФГБУН «ФИЦ питания, биотехнологии и безопасности пищи», Москва, Российская Федерация2- ГОУ ВПО Российский государственный социальный университет, Москва, Российская Федерация
Гиоева Земфира Маирбековна, аспирант отделения сердечно-сосудистой патологии ФГБУН «ФИЦ питания, биотехнологии и безопасности пищи», regach13@yandex.ru
Богданов Альфред Равилевич — кандидат медицинских наук, заведующий отделением сердечно-сосудистой патологии ФГБУН «ФИЦ питания, биотехнологии и безопасности пищи», доцент кафедры гастроэнтерологии и диетологии ФДПО ГБОУ ВПО РНИМУ им. Н. И. Пирогова Минздрава России; bogdanov.ar@mail.ru
Зайнудинов Зайнудин Мусаевич, доктор медицинских наук, главный врач ФГБУН «ФИЦ питания, биотехнологии и безопасности пищи», zain_z@mail.ru
Резюме
Цель. Оценить динамику показателей антропометрии, композиционного состава тела, показателей гемодинамики, толерантности к физической нагрузке у пациентов с ожирением и сердечной недостаточностью на фоне диетотерапии с включением гидролизата белка дрожжей сублимационной сушки в течение 2-х недель.Пациенты и методы. Изучались 46 больных с ожирением и сердечной недостаточностью, которые были рандомизированы случайным образом на две группы, отличающиеся методом диетологического лечения. Обе группы в течение 14 дней получали стандартную гипонатриевую низкокалорийную диету. Пациенты из основной группы дополнительно получали гидролизат белка дрожжей сублимационной сушки по 30 г в сутки, произведенного компанией ООО «ГЕДА». У больных оценивали показатели композиционного состава тела, основного обмена методом непрямой респираторной калориметрии, исследование показателей метаболизма при физической нагрузке.
Результаты. Показано, что применение гидролизата белка дрожжей сублимационной сушки на фоне низкокалорийной диетотерапии приводит к достоверно более быстрой и более выраженной редукции жировой массы тела у больных, возможно, за счет повышения эффективности метаболизации жиров скелетной мускулатурой, а также предотвращает редукцию мышечной массы тела на фоне низкокалорийной диетотерапии. Установлено, что в результате проведенного комплексного лечения у пациентов основной группы было выявлено достоверное снижение количества баллов по шкале оценки сердечной недостаточности у больных ожирением, в то время как у пациентов группы сравнения динамика среднего балла по шкале оценки сердечной недостаточности у больных ожирением была существенно менее выраженной. Также выявлено, что несмотря на увеличение квоты белка в рационе, окислительный метаболизм белков у больных не повышается, следовательно, гидролизат белка дрожжей сублимационной сушки выполняет преимущественно пластическую функцию.
Ключевые слова: антропометрия, белковая добавка, диетотерапия, ожирение, сердечная недостаточность.
Введение
Ожирение — хроническое гетерогенное заболевание, связанное с рядом генетических и поведенческих факторов, изменениями эндокринной системы, нарушением энергетического баланса и метаболизма нутриентов [1, 2, 3]. В настоящее время ВОЗ рассматривает эту патологию как эпидемию, охватившую миллионы людей, и предполагает, что к 2025 г. число лиц с ожирением в мире составит около 300 млн. человек [4, 5, 6]. Согласно мнению ряда экспертов и опубликованным данным эпидемиологических исследований, смещение композиционного состава тела в сторону увеличения жировой массы и уменьшения мышечной массы ассоциировано с увеличением смертности от кардиоваскулярных заболеваний. Также показано, что постепенное увеличение массы тела является линейным трендом в общей популяции взрослого населения земного шара [7, 8].Социальная значимость проблемы ожирения определяется угрозой инвалидизации пациентов, снижением качества жизни и ее продолжительности в связи с частым развитием тяжелых сопутствующих заболеваний: Риск развития этих заболеваний возрастает в значительной степени при увеличении индекса массы тела [9, 10].
В этой связи формирование правильных привычек питания, сбалансированная диета и активный образ жизни становятся ключевыми факторами лечебного воздействия на этапах коррекции начальных стадий и профилактики прогрессирования ожирения, развития сахарного диабета и сердечно-сосудистых заболеваний [11,12].
На основании анализа опубликованных данных представляет интерес клиническое наблюдение с целью подтверждения эффекта новых биологически активных добавок к пище в качестве независимого алиментарного фактора коррекции антропометрических показателей и композиционного состава тела у больных с ожирением и сердечной недостаточностью.
Материалы исследования
Открытое проспективное наблюдение было организовано на базе отделения сердечно-сосудистой патологии ФГБУН «ФИЦ питания, биотехнологии и безопасности пищи» и проводилось с 15 октября по 15 декабря 2016 года.Цель исследования: оценить динамику показателей антропометрии, композиционного состава тела, показателей гемодинамики, толерантности к физической нагрузке у пациентов с ожирением и сердечной недостаточностью на фоне диетотерапии с включением добавки белковой сушеной «Геда» в течение 2-х недель.
Принимая во внимание неинтервенционный характер данного наблюдения, оно регламентировалось одобрением Комитета по этике ФГБУН «ФИЦ питания, биотехнологии и безопасности пищи». 46 пациентам с ожирением II-III степени и сердечной недостаточностью, госпитализированным с целью получения специализированного курса диетотерапии, было предложено принять участие в представляемом наблюдении. Все пациенты были информированы о целях и характере наблюдения.
Диагноз ожирения ставился исходя из значения индекса массы тела (ИМТ) более 35 кг/м2. Диагноз диастолической сердечной недостаточности (ДСН) выставлялся в случае сочетания клинических симптомов сердечной недостаточности (СН), признаков диастолической дисфункции миокарда ЛЖ по данным эхокардиографии (эхоКГ) и повышения уровня натрийуретического пептида (NT-proBNP) в плазме крови.
Больные были рандомизированы случайным образом на две группы, отличающиеся методом диетологического лечения. Обе группы в течение 14 дней получали стандартную гипонатриевую низкокалорийную диету (НКД) — диету со значительным ограничением количества жиров и легкоусвояемых углеводов, нормальным содержанием белка и сложных углеводов, увеличенным количеством пищевых волокон. Ограничивалась поваренная соль (3−5 г/день). Химический состав: белки — 70−80 г, в т. ч. животные 40 г; жиры общие — 60−70 г, в т. ч. растительные 25 г; углеводы общие — 130−150 г, пищевые волокна — 30−40 г. Энергетическая ценность 1350−1550 ккал. Пациенты I группы (23 пациента) — на фоне НКД получали добавку белковую сушеную «Геда» по 30 г в сутки, произведенного компанией ООО «ГЕДА» — гидролизат белка дрожжей сублимационной сушки — таблица 1. Пациенты II группы (23 пациента) — группа контроля — получали только гипонатриевую антиатерогенную диету. Химический состав рациона питания больных обеих групп представлен в таблице 2.
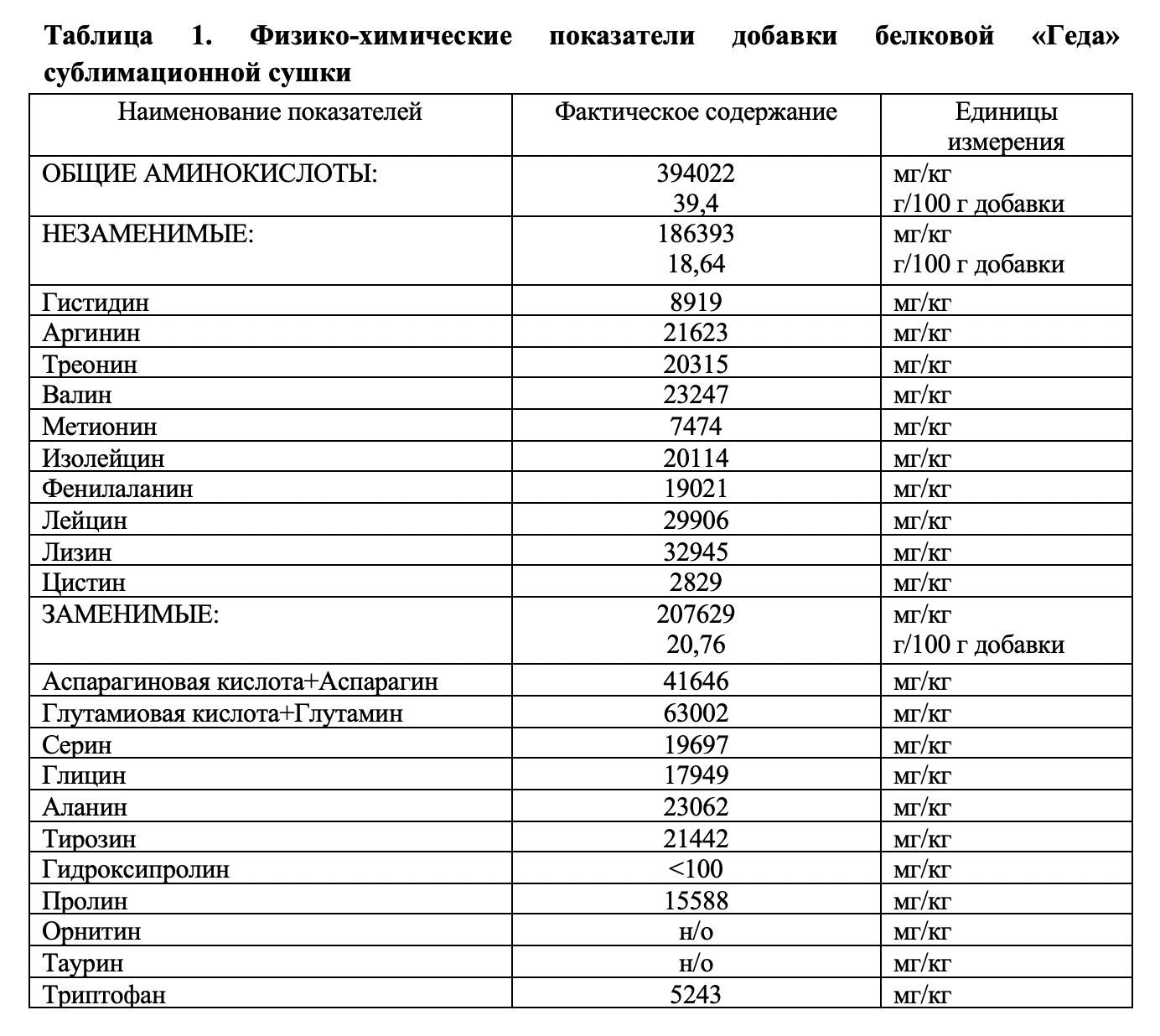


где ИМТ — индекс массы тела, ШОКС — баллы по шкале оценки клинического статуса в модификации Мареева (2005 г.), ММЛЖ — масса миокарда левого желудочка, ИММЛЖ — индекс массы миокарда левого желудочка, ФВ ЛЖ — фракция выброса ЛЖ, ФУ ЛЖ — фракция укорочения ЛЖ, Ср. ДЛА — среднее давление в легочной артерии, СистДЛА — систолическое давление в легочной артерии, ДД — диастолическая дисфункция, NT-proBNP — содержание N-концевой предшественника мозгового натрийуретического пептида.
Нормальные показатели эхокардиографии приведены по рекомендациям Американского общества эхокардиографистов (Shiller, 1991).Последовательность и описание периодов исследования. Общая продолжительность участия в исследовании каждого больного составила 14 дней. Скрининг больных осуществлялся на догоспитальном этапе. На соответствие критериям включения были скринированы все больные, обратившиеся в отделение сердечно-сосудистой патологии ФГБУН «ФИЦ питания, биотехнологии и безопасности пищи». Процедура скрининга включала в себя клинические обследование для определения соответствия пациентов критериям включения в исследование и отсутствия у них критериев невключения в исследование. Пациентам, соответствующим критериям включения, было предложено принять участие в данном исследовании. После подписания пациентами формы информированного согласия им присваивался порядковый номер. Визит 1 (день 1) — в день госпитализации, в соответствии с протоколом исследования, проводился физикальный осмотр больных, антропометрические исследования, исследование композиционного состава тела, проба с 6-минутной ходьбой, исследование энерготрат и скорости окисления жиров в условиях основного обмена, нагрузочное кардиореспираторное исследование, забор крови для анализа. Визит 2 (день 14) соответствовал дню выписки из стационара. Проводились антропометрические исследования, исследование композиционного состава тела, основного обмена, нагрузочное кардиореспираторное исследование, забор крови для анализа.
Методы исследования
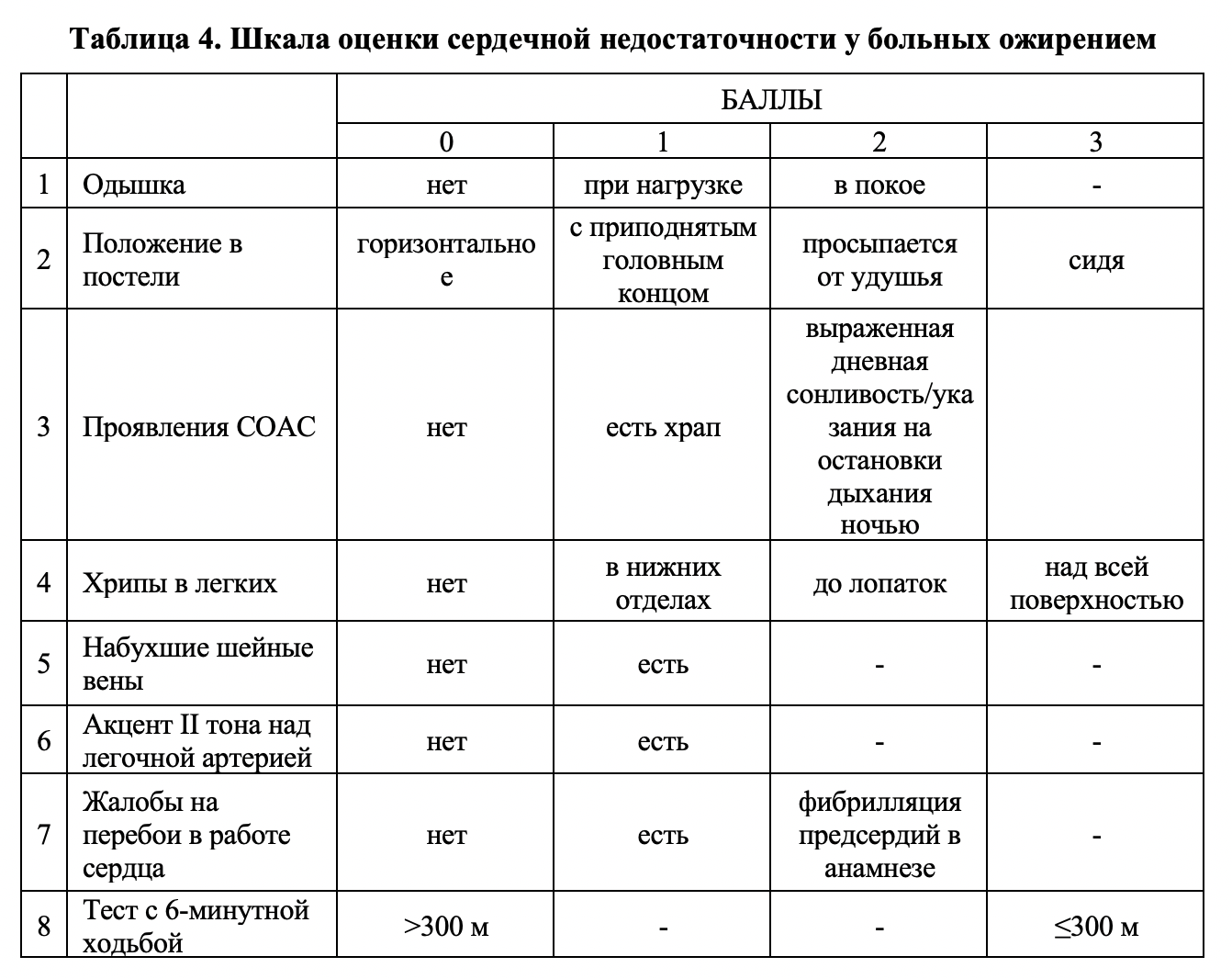
Клинико-инструментальная диагностика пищевого статуса включала в себя антропометрические исследования, оценку композиционного состава тела, исследование энерготрат покоя (ЭП) с определением суточной экскреции азота, исследование показателей метаболизма при физической нагрузке (нагрузочная калориметрия, кардиореспираторное нагрузочное тестирование). Антропометрические исследования включали в себя измерение массы тела, роста, окружности талии (ОТ) и обхвата бедер (ОБ), расчет индекса массы тела и соотношения ОТ/ОБ. Индекс массы тела (ИМТ) рассчитывался по формуле Кетле: ИМТ=масса тела (кг)/рост (м2). Композиционный состав тела исследовали методом биоимпедансного анализа состава тела с помощью анализатора InBody520 (InBody, Корея), а также «АВС-01» фирмы «МЕДАСС» (Россия). Исследование энерготрат покоя (ЭП) с определением суточной экскреции азота исследовали прибором «Quark RMR Cart» (COSMED, Италия). Определяли показатели энерготрат покоя (ккал/сут), скорости окисления основных макронутриентов (белков, жиров, углеводов). Скорость окисления белков (СОБ, г/сут), жиров (СОЖ, г/сут) и углеводов (СОУ, г/сут) рассчитывали с использованием уравнения Вейра. Полученные данные сравнивали с ожидаемыми величинами, рассчитанными по формуле Харрисона-Бенедикта. Исследование показателей метаболизма при физической нагрузке включало проведение нагрузочного кардиореспираторного тестирования (НКРТ), которое проводили с использованием прибора «Quark CPET RMR» (COSMED, Италия). Методика дает возможность объективно оценить уровень физической работоспособности, определить патогенетические механизмы, приведшие к ее снижению, вклад различных систем, участвующих в формировании ответа организма на нагрузку: дыхания и кровообращения, кроветворения, нейрогенной регуляции, метаболизма и скелетных мышц. Нагрузочное тестирование проводилось с использованием протокола модифицированный BRUCE (Mod BRUCE). Клинические методы и функциональные методы исследования включали сбор жалоб, анамнез заболевания, физикальный осмотр больного с использованием стандартных подходов, количество баллов по шкале оценки клинического состояния (ШОКС), пробу с 6-минутной ходьбой, электрокардиографию, трансторакальную эхокардиографию, суточное мониторирование ЭКГ и артериального давления. Для оценки клинического статуса больных с сердечной недостаточностью использовалась шкала оценки сердечной недостаточности у больных ожирением (ШОСНО) — таблица 4.
Проба с 6-минутной ходьбой заключается в том, что нужно измерить дистанцию, которую в состоянии пройти больной в течение 6 мин: 1 ФК ХСН преодоление расстояния от 426 до 550 метров; 2 ФК ХСН — 301−425 м; 3 ФК ХСН — 150−300 м; 4 ФК ХСН — менее 150 м. Электрокардиография (12-канальная ЭКГ) проводилась с использованием электрокардиографа Schiller AT-2 plus (Германия), по стандартной методике. Трансторакальная эхокардиография (ЭхоКГ) проводилась с использованием аппарата Philips iE33 в соответствии с рекомендациями Американского общества эхокардиографистов (ASE) и Европейской ассоциации по сердечно-сосудистой визуализации (EACVI) (2015). При этом проводилось определение ширины и объема левого предсердия (ЛП), толщины межжелудочковой перегородки (ТМЖП,) и задней стенки левого желудочка (ТЗСЛЖ), а также, конечного диастолического размера левого желудочка (КДР), конечного систолического размера левого желудочка (КСР), фракции выброса (ФВ), рассчитывались максимальные скорости раннего (Е) и позднего (А) диастолического наполнения и их отношение (Е/А), время изоволюмического расслабления (ВИВР), время замедления раннего диастолического наполнения (ВЗЕ), соотношение максимальных скоростей E трансмитрального кровотока и диастолического подъема основания ЛЖ в раннюю диастолу (E/e'), масса миокарда левого желудочка (ММЛЖ) и индекс массы миокарда левого желудочка (ИММЛЖ). Лабораторные исследования включали изучение биохимических маркеров липидного, белкового и углеводного обмена. Биохимические исследования проводили с использованием биохимического анализатора «Konelab 30i» фирмы «Thermo Clinical Lab systems» (Финляндия). Статистическая обработка результатов проводилась с помощью программы STATISTICA, версия 10.0. При анализе основных характеристик пациентов использовались параметрические критерии, и данные представлялись как среднее ± стандартное отклонение или % от общего числа пациентов. В остальных случаях использовались непараметрические критерии: для номинальных и категориальных данных критерий χ2, для числовых данных U-критерий Манна-Уитни и тест Крускала-Уолиса, для оценки взаимосвязи между переменными использовался коэффициент ρ Спирмана и r Пирсона. В этом случае данные представлялись как медиана [25;75 перцинтиль] или % от общего числа пациентов. Сравнение и оценка значимости различий проводились также с использованием непараметрических методов: U-критерий Манна-Уитни; для оценки взаимосвязи между переменными использовался коэффициент ρ Спирмана. Вероятность p<0,05 считали достаточной для вывода о достоверности различий между вариационными рядами; при p>0,05 разницу между величинами расценивали как статистически не достоверную.
Полученные результаты
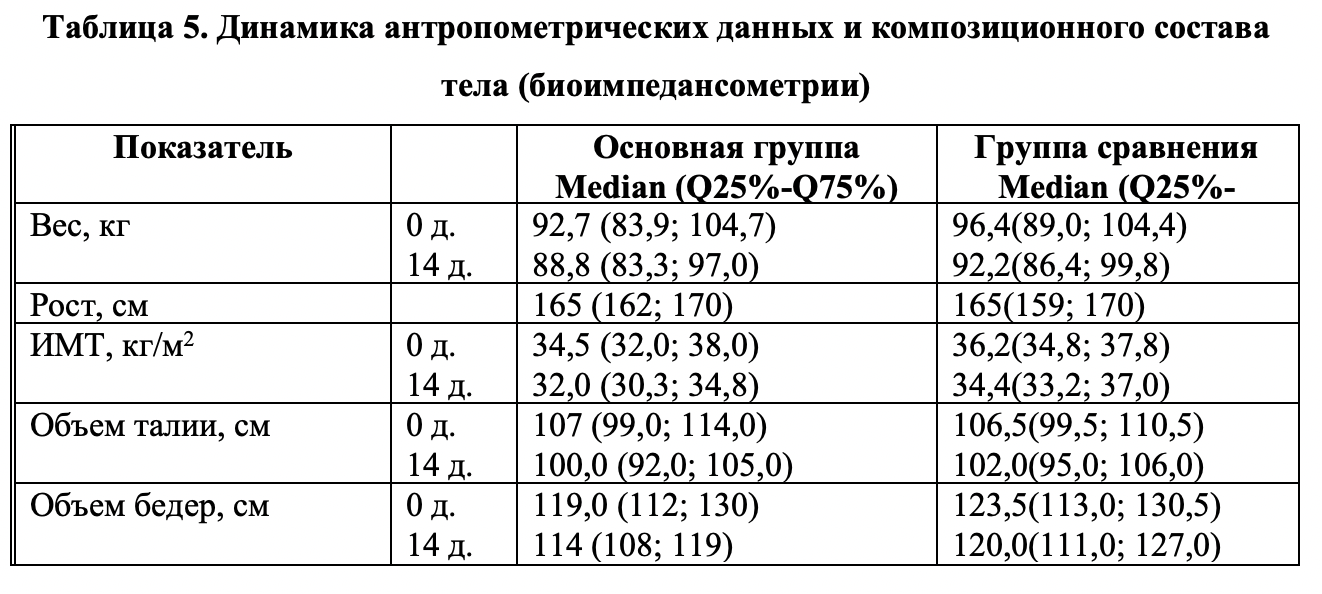
Показатели антропометрии. В результате проведенного курса диетотерапии в обеих наблюдаемых группах больных отмечена удовлетворительная редукция массы тела, более выраженная в основной группе. Так, масса тела у пациентов основной группы снизилась за 14-дневный курс лечения с 96,7 (83,9; 104,7) кг до 88,8 (83,3; 97,0) кг, а у пациентов группы сравнения с 96,4 (89,0; 104,4) кг до 92,2 (86,4; 99,8) кг., причем среднее снижение массы тела на 14-й день составило -4,5 (-5,7; -3,3) кг в основной группе и -3,9 (-4,9; -3,1) кг в группе сравнения. Индекс массы тела снизился с 34,5 (32,0; 38,0) до 32,0 (30,3; 34,8) кг/м2 в основной группе и с 36,2 (34,8; 37,8) до 34,4 (33,2; 37,0) кг/м2 в группе сравнения, причем среднее снижение ИМТ в основной группе составило -1,6 (-2,1; -1,3) и -1,4 (-1,8; -1,1) кг/м2 в группе сравнения. Различия в величине уровня среднего снижения ИМТ позволяют сделать заключение о наличии тренда различий в динамике снижения данного показателя в основной группе по сравнению с группой контроля (см. табл. 5.).
Исследование показателей композиционного состава тела. Результаты исследования композиционного состава тела больных методом биоимпедансометрии представлены в таблице 6.
Динамика жировой массы тела у больных. На фоне лечения выявлены существенные различия между группами. Наибольший интерес представляет главный целевой показатель терапии ожирения — динамика жировой массы (ЖМ) тела. Как видно из таблицы 5, больные основной группы характеризовались существенно более выраженной редукцией ЖМ по сравнению с пациентами контрольной группы: ЖМ к окончанию лечения — в ОГ ЖМ снизилась на 4,05 кг (7,3%, р<0,05) от исходного значения, в то время как в КГ редукция ЖМ составила 2,2 кг (3,7%, р=0,052) и была статистически не достоверна. Сравнительный попарный анализ групп по t-критерию Стьюдента показал наличие статистических различий между средними выборочными групп в конечной точке исследования при уровне значимости р=0,009. Из данных таблицы 5 видно, что исходные соотношения основных показателей композиционного состава тела (жировая масса, тощая масса, общая жидкость) в обеих группах сопоставимы.
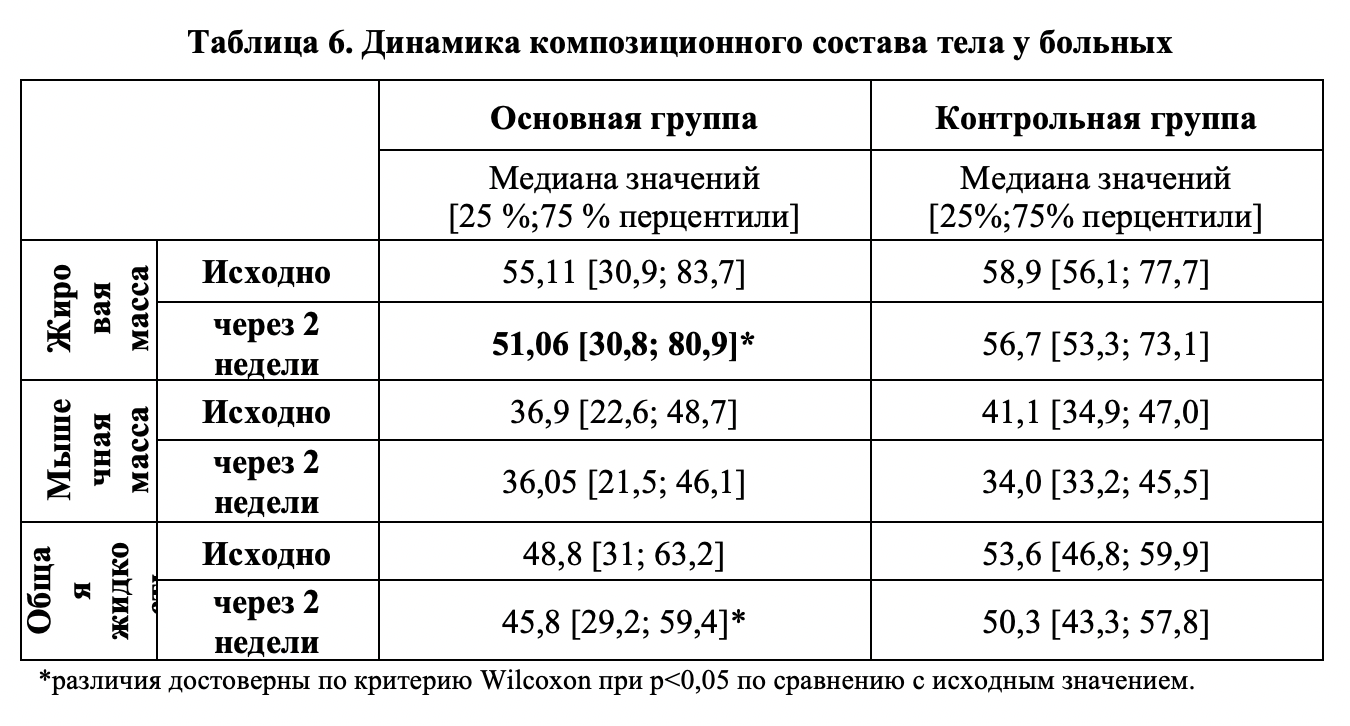
Динамика мышечной массы тела у больных. Анализ изменений мышечной массы (ММ) тела у больных показал, что в контрольной группе (КГ) наблюдается типичная реакция организма на низкокалорийную диетотерапию в виде снижения ММ на 1,85 [1,1; 2,6] кг (на 5,01%, р=0,067) в течение 2-х недель стационарного лечения. Показатель М М у больных основной группы (ОГ) за две недели не изменился — средняя редукция ММ составила всего 0,85 [0,01; 1,5] кг и имела недостоверный характер (р=0,68). Таким образом, включение в диету добавки белковой сушеной «Геда» позволяет добиться протекции мышечной массы на фоне низкокалорийной диеты. Следует отметить, что у больных ОГ на фоне сохранения ММ происходит достоверно более выраженная редукция ЖМ. Это может свидетельствовать о том, что у больных ОГ на фоне приема добавки белковой сушеной «Геда» повышается эффективность метаболизации жиров скелетной мускулатурой, то есть одна единица ММ у этих больных окисляет большее количество жиров.
Динамика общей жидкости у больных. Анализ изменений содержания общей жидкости в организме наблюдаемых больных показал, что в обеих группах за две недели лечения наблюдалась потеря жидкости — у больных ОГ на 3,0 [0,8; 3,8] л (6,14%, р<0,05), а у больных КГ — на 3,3 [2,2; 3,5] л (на 6,1%, р=0,07). Подобные колебания ОЖ, вероятнее всего, обусловлены тем, что в стационаре больные находятся в контролируемых условиях гипонатриевого рациона питания, что приводит к выраженному диуретическому эффекту.
На наш взгляд, представленные выше результаты измерения состава тела методом биоимпедансометрии позволяют сделать несколько выводов — применение добавки белковой сушеной «Геда» на фоне низкокалорийной диетотерапии, по сравнению с пациентами, получающими только диетотерапию: 1) приводит к достоверно более быстрой и более выраженной редукции жировой массы тела у больных, возможно, за счет повышения эффективности метаболизации жиров скелетной мускулатурой; 2) предотвращает редукцию мышечной массы тела на фоне низкокалорийной диетотерапии.
Показатели энерготрат покоя. Анализ результатов непрямой респираторной калориметрии (таблица 7) не выявил существенного изменения энерготрат покоя у пациентов в обеих группах. В основной группе повышение величины энерготрат покоя составило в среднем 171 ккал/сут. — с 1364 (1301; 1689) до 1535 (1258; 1642) ккал/сутки. Различие по этому показателю в начале и при завершении исследования нельзя назвать статистически достоверным (p>0,6). В группе сравнения энерготраты покоя снизились по окончании лечения с 1424 (1284; 1640) до 1288 (1137; 1537) ккал/сутки, что является менее благоприятным моментом, однако данные различия также нельзя назвать статистически значимыми (p<0,12). В основной группе было выявлено достоверное повышение скорости окисления жиров (СОЖ) на 27 (19; 54) г/сут. (28,1%) — с 96 (56; 135) до 123 (108; 168) г/сутки (p<0,05), а в группе сравнения СОЖ снизилась с 83 (49; 116) г/сутки до 63 (26; 83) г/сутки (p< 0,08).

Показатели толерантности к физической нагрузке. Проводимое лечение в обеих группах способствовало повышению толерантности к физической нагрузке, о чем можно судить по повышению максимального расстояния, пройденного пациентом за 6 минут. При сравнении теста с 6ти-минутной ходьбой в начале исследования и по завершении в основной группе зафиксированы статистически значимые результаты (р<0,004); изменения составили с 400 (389; 510) м до 520 (482; 560) м. Изменение в группе контроля: с 430 (300; 440) м до 470 (440; 490) м, также статистически значимы (p<0,01) (см. таблицу 8). Различий в средних значениях изменения теста с 6ти-минутной ходьбой в начале и конце исследования, рассчитанных по индивидуальным значениям, между основной группой и группой контроля были достоверны при р=0,012.
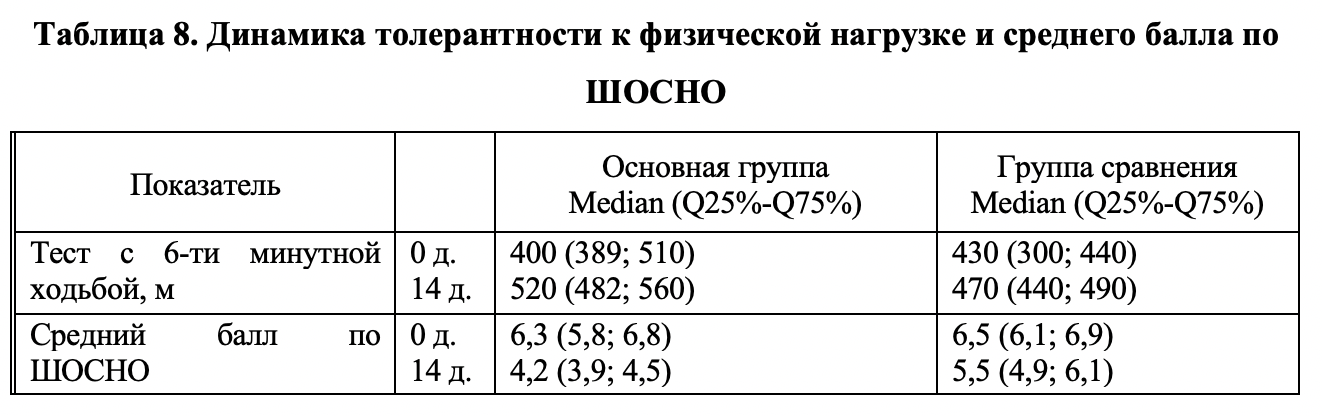
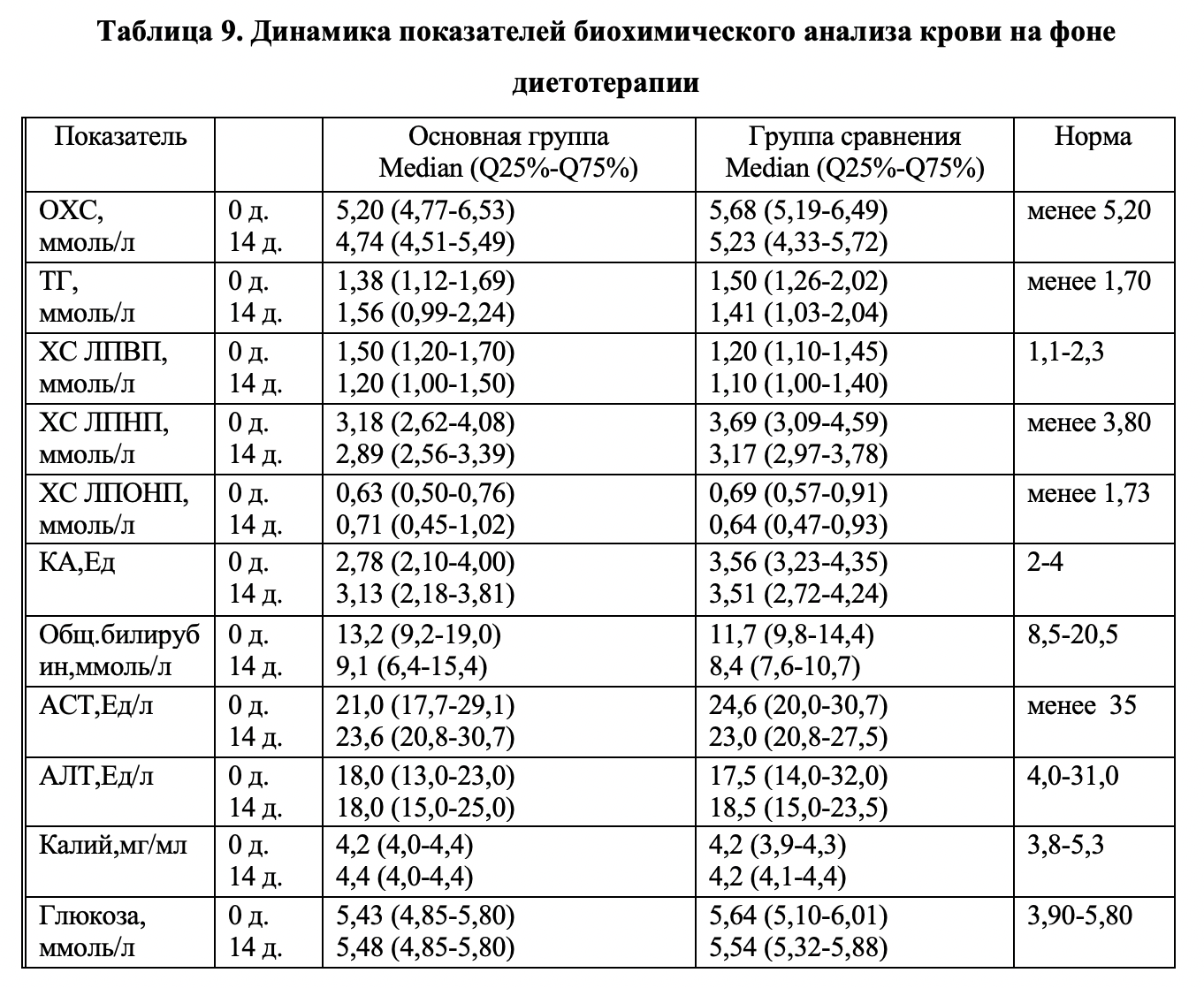
Показатели биохимического анализа крови больных. Результаты исследования динамики биохимических показателей представлены в таблице 9. В обеих группах больных медианы показателей липидного спектра крови находились в пределах нормальных значений, за исключением медианы общего холестерина в группе сравнения, которая была несколько выше. На фоне проводимой диетотерапии была отмечена тенденция к снижению уровня ОХС, ХС-ЛПВП, ХС-ЛПНП в обеих группах. При этом, показатели не вышли за пределы нормы. В основной группе была выявлена тенденция к увеличению уровня триглицеридов (при сохранении значений в пределах нормы), что может быть расценено как косвенный маркер интенсификации липолиза у этих больных. Эти данные свидетельствуют об отсутствии значимого ухудшения липидного спектра крови на фоне лечения.
Результаты исследования биомаркеров протеинового обмена представлены в таблице 10. Анализировалось содержание общего белка в сыворотке крови, а также основные продукты метаболизма аминокислот. Было показано, что уровень общего белка крови в обеих исследуемых группах оставался в пределах физиологической нормы в течение всего периода наблюдения. Различий между средними выборочными по этому показателю в группах не выявлено. Иные данные были получены в ходе анализа содержания креатинина сыворотки крови. Несмотря на то, что в течение всего периода наблюдения уровень креатинина не превышал нормальные значения, было выявлено его незначительное увеличение на фоне снижения массы тела в обеих группах больных.
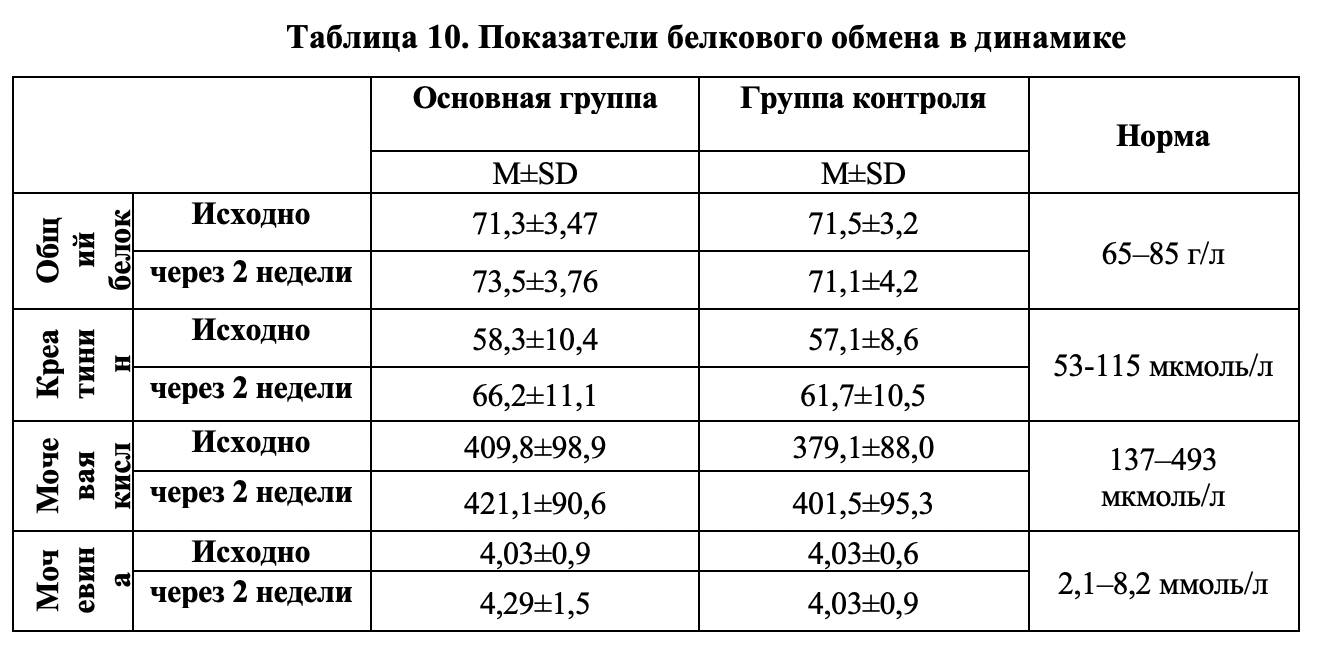
Представленные данные свидетельствуют о том, что несмотря на увеличение квоты белка в рационе, окислительный метаболизм белков у больных не повышается, следовательно, аминокислоты «Геда» выполняют преимущественно пластическую функцию. Это косвенно подтверждается описанным выше протективным влиянием добавки белковой сушеной «Геда» на мышечную массу больных по данным биоимпедансометрии.
Выводы
На основании проведенного исследования можно заключить, что включение в диету добавки белковой сушеной «Геда» приводит к следующим эффектам:1. Более выраженной редукции жировой массы тела, показателей антропометрии (объема талии и бедер).
2. Повышению энерготрат покоя за счет увеличения скорости окисления жиров, очевидно, за счет повышения эффективности метаболизации жиров скелетной мускулатурой.
3. Предотвращению редукции мышечной массы тела на фоне низкокалорийной диетотерапии.
4. Повышению толерантности к физической нагрузке.
5. Снижение клинических проявлений хронической сердечной недостаточности в виде снижения среднего балла по шкале оценки сердечной недостаточности при ожирении и результатам теста с 6ти-минутной ходьбой.
6. Анализ данных по переносимости добавки белковой сушеной «Геда» позволяет заключить, что средство хорошо переносится, не вызывая при своем применении явлений диспепсии, аллергических реакций или каких-либо других побочных эффектов.
В соответствие с техническим регламентом ТС021/2011, добавка белковая сушеная «Геда» обладает заданной пищевой и энергетической ценностью, физическими и органолептическими свойствами, соответствует требованиям безопасности (декларация о соответствии ТС N RU Д-RU.AIO20.B.282 — см. приложение) и обладает клинической эффективностью в виде оптимизации влияния лечебной диеты на показатели композиционного состава тела, а также снижения симптоматики сердечной недостаточности и увеличения толерантности к физической нагрузке у больных с ожирением. Таким образом, добавка белковая сушеная «Геда» может быть рекомендована для использования в составе лечебных диет для больных с ожирением и ХСН, и следовательно может классифицироваться как специализированный диетический (лечебный) пищевой продукт.
Литература
1. Бутрова С. А. Ожирение. Современная тактика ведения больных.// Леч. врач. — 2000. — № 5. — С. 30−33.2. Гинзбург М. М., Крюков Н. Н. Ожирение. Влияние на развитие метаболического синдрома, профилактика и лечение.// М.: Медпрактика, 2002 — 127 с.,
3. LindeJ.A., JefferyR.W., LevyR.L., Sherwood N.E., Utter J., Pronk N.P., et al. Binge eating disorder, weight control self-efficacy, and depression in overweight men and women // Int. J. Obes. Relat. Metab. Disord. — 2004 — № 28. — Р. 418−425.
4. Перова Н. В., Метельская В. А., Оганов Р. Г. Патогенетические основы метаболического синдрома как состояния высокого риска атеросклеротических заболеваний.// Международный медицинский журнал.- 2001. — № 7(3). — С.6−10.
5. Adams K.F., Schatzkin A., Harris T.B., Kipnis V., Mouw T., Ballard-Barbash R., et al. Overweight, obesity and mortality in a large prospective cohort of persons 50 to 71 years old // N. Engl. J. Med. — 2006. — №.355.-Р. 763−778.
6. WHO: Obesity: Preventing and managing the global epidemic. Report of a WHO consultation. — Geneva, WHO Technical Report Series, 2000. — p. 894.
7. Lenz М., Richter Т., Mühlhauser I. The Morbidity and Mortality Associated With Overweight and Obesity in Adulthood. A Systematic Review. Deutsches Ärzteblatt International 2009; 106(40): 641−8.
8. Quinn E. The most common methods to measure body composition and body fat. http://sportsmedicine.about.com/od/fitnessevalandassessment/a/Body_Fat_Comp.htm
9. Knowler W.C., Barrett-Connor E., Fowler S.E., Hamman R.F., Lachin J.M., Walker E.A., et al/ Diabetes Prevention Program Research Group: Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin // N. Engl. J. Med. — 2002. — №.346.-Р. 393−403.
10. Sampsel S., May J. Assessment and management of obesity and comorbid conditions // Dis. Manag. — 2007. — № 1. — Р. 252−265.
11. Гриневич В. Б. Концепция функционального питания в комплексной терапии внутренних болезней. http://www.terramedica.spb.ru/1_2007.
12. Бутрова А. С. Метаболический синдром: патогенез, клиника, диагностика, подходы к лечению. 2001, Т 9, № 2.
